Согласно постановлению Кабинета Министров Украины № 1419 от 28 октября 2004 года, все предприятия фармацевтической отрасли должны быть сертифицированы в соответствии с правилами надлежащей производственной практики, более известными под аббревиатурой GMP (Good Manufacturing Practice, www.fda.gov/cdrh/comp/gmp.html).
 Контроль качества ERP-системой |
В рамках этого стандарта все производственные процессы предприятий — производителей лекарственных средств должны соответствовать определенным требованиям для обеспечения качества продукции. Процесс проверки этого соответствия называется валидацией и производится для каждой составляющей производственного цикла.
Большинство фармацевтических предприятий Украины, а также некоторые производители продуктов питания уже валидировали производственные процессы. Проблемы могут возникнуть при попытке валидации процессов, управляемых информационными компьютерными системами. К ERP в производственной практике предъявляются особые требования, так как эта система является основным “контролёром” производственных процессов. Предприятия, использующие информационные системы, написанные собственными силами, вряд ли учитывали при разработке высокие требования GMP, а видоизменение отлаженной системы может повлечь за собой колоссальные затраты ресурсов. В то же время далеко не каждый интегратор имеет опыт валидации информационных систем по условиям GMP.
Об особенностях процессов интеграции и последующей валидации ERP согласились рассказать сотрудники Борщаговского химико-фармацевтического завода (БХФЗ): Алла Довгенко (аналитик компьютерных систем), Леонид Медведев (начальник отдела ИТ) и Василий Гейко (руководитель группы поддержки прикладного ПО).
PCWeek/UE: Как происходил выбор информационной системы? Что было решающим критерием?
В. Г.: Во-первых, цена. Конкурентные системы от Oracle или SAP слишком дороги для среднего украинского предприятия. Во-вторых, мы искали компанию-интегратора с опытом внедрения систем по стандарту GMP. Я уверен, что и Oracle и SAP имеют специальные разработки для фармакологической промышленности, но, к сожалению, когда мы занялись вопросом подбора интегратора, никто не смог нам предложить вариант для процесса валидации. Оказалось, что никто не имеет опыта внедрения подобных решений на фармацевтических предприятиях.
А. Д.: Мы провели небольшой тендер, и решающим (в границах определенного бюджета) было мнение ИТ-отдела. Но на предприятии все ключевые лица имели возможность ознакомиться с разными вариантами. Кроме того, систему, которую мы впоследствии выбрали, MFG/PRO производства компании QAD, нам в 2000-м году показывали в работе на чешском предприятии похожей специфики.
PCWeek/UE: Кто осуществляет техническую поддержку вашей ERP-системы?
А. Д.: Наш ИТ-отдел. А над доработкой системы и поддержкой функционально-сти работает интегратор, компания SoftServe.
В. Г.: MFG/PRO — система открытая и хорошо документированная. Описаны все структуры данных, и сотрудники ИТ-отдела по документации смогут понять, как и что в системе происходит. Программисты компании могут даже писать собственные доработки. Формы отчетов, например. Правда, внутренними силами лучше не делать серьезных надстроек, поскольку они могут быть утеряны при обновлении системы.
Л. М.: Обучение конечных пользователей и сотрудников ИТ-отдела — одно из требований к персоналу по GMP. Процесс обучения должен быть задокументирован, чтобы при аудите можно было этот факт проверить.
А. Д.: Все ключевые пользователи системы после обучения сдавали экзамен и получили сертификаты. Обучение было одной из первых стадий внедрения системы на предприятии.
PCWeek/UE: Менялись ли на БХФЗ какие-либо бизнес-процессы?
Л. М.: Конечно, компании-интеграторы советуют адаптировать бизнес-процессы под стандартную схему. Если потребуется — применить реинжиниринг процессов и, возможно даже, изменить структуру предприятия. И это правильный подход. На Западе он применяется в большинстве случаев, поскольку позволяет снизить общую стоимость владения системой. Но предприятия в нашей стране имеют свою специфику. Не всегда можно свои бизнес-процессы привести в полное соответствие со стандартными. Это обусловлено разными факторами, например, устаревшим оборудованием либо чем-то еще, что объективно влияет на этот процесс. Часто приходится идти на компромисс: где-то модернизировать имеющиеся бизнес-процессы, где-то оставить как есть, где-то поменять структуру предприятия. Формировать же совершенно новые бизнес-процессы нереально и связано с большими затратами.
У нас несколько изменилась структура предприятия. Появилось новое подразделение, отвечающее за внедренную систему. Внесены некоторые изменения в стандартные процессы производства.
А. Д.: На бизнес-процессы сильно влияет наш, отечественный, финансовый учет. Поэтому значительные изменения претерпел и учет материальный. В ERP-системе настолько четко и стройно продумано движение материалов, что мы со своим очень “зарегулированным” учетом вмешиваемся в ERP просто по-варварски. Но с этим ничего нельзя было сделать.
PCWeek/UE: Какое оборудование пришлось валидировать на БХФЗ?
Л. М.: Мы валидировали практически все управляемое компьютером оборудование, влияющее на качество продукции.
В. Г.: Применительно к системам ERP, все бизнес-процессы должны быть описаны. На основе этих описаний проводится валидация. Кстати, минимальные требования допускают проводить валидацию только тех процессов, которые непосредственно влияют на качество продукции.
А. Д.: Те процессы информационной системы, которые задействованы в производстве, хранении и реализации готовой продукции и влияют на ее качество даже косвенным путем, тоже валидируют по условиям GMP. У нас валидирована не вся система, а только та часть, которая влияет на качество продукции.
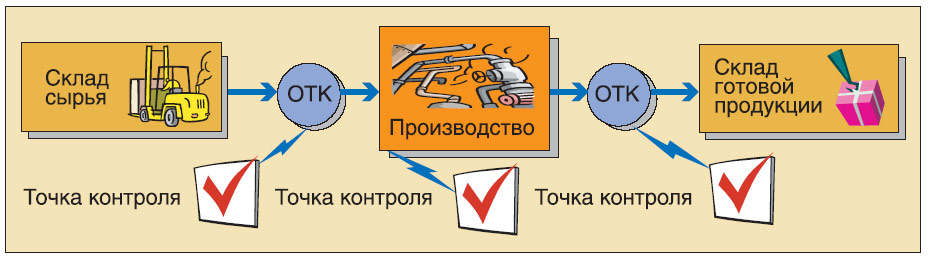
Л. М.: В нашей ERP-системе реализованы такие три сферы: дистрибуция, финансы и производство. В области дистрибуции описаны процессы продаж, покупки и хранения. Например: выпущена серия лекарственного средства. С внутреннего склада какого-либо цеха оно передается на склад готовой продукции с сопроводительными документами в бумажном виде. Контролер должен иметь возможность узнать точное обозначение серии товара, дату производства, количество и пр.
Согласно требованиям стандарта GMP, система позволяет определить, какая серия, кому и когда была продана. Это очень важно на случай, например, товарного брака, для того чтобы можно было оперативно отозвать партию и отследить, какие компоненты входили в состав именно этой серии.
А. Д.: Дело в том, что на производстве передача продукта происходит по определённому документу. И когда сырье приходит на склад, оно по правилам попадает под карантин. Это описано в информационной системе. Право отменить карантин имеет только ОТК. Пока ОТК не проверит это сырье, оно не будет выдано. За этим следит система. Далее, пока готовая продукция находится на карантине, она не поступит на склад готовой продукции. Система за этим следит и не позволит ее продать, пока нет сертификата качества.
Л. М.: И именно валидация доказывает, что этот процесс выполняется правильно. Если во время прохождения валидации эксперты обнаружат в системе возможность передать сырье в производство без визы ОТК, процесс подлежит реинжинирингу.
ЗАО НПЦ “Борщаговский химико-фармацевтический завод” — один из лидеров фармацевтической индустрии Украины, выпускающий более 120 наименований лекарственных средств, 45 из которых ранее в Украине не производились. Количество работающих — более 600 человек. Завод экспортирует продукцию в 10 стран мира, доля экспорта в общих продажах завода составляет 12%. Годовая мощность предприятия по производству таблеток составляет около 200 млн. уп. №10, антибиотиков в капсулах — 15 млн. уп. №10, стерильных антибиотиков во флаконах — 12 млн. шт.











.jpg)



